وسیلهای قابل ایمپلنت (کاشت در بدن) که درد را تسکین میدهد
این وسیلهی قابلانعطاف بدون نیاز به سخت افزاری حجیم و محکم، همراه با بدن کشیده و خم میشود. این وسیلهی جدید میتواند جایگزینی برای مسکنها و داروهای اعتیادآور باشد.
این تحقیقات به دانشگاه نورت وسترن مربوط میشود.
یک ایمپلنت کوچک و قابلانعطاف که در صورت نیاز بدون دارو درد را تسکین میدهد توسط محققان دانشگاه نورت وسترن توسعه یافته است. این وسیله در نوع خود بینظیر است و میتواند جایگزینی برای مسکنها و داروهای اعتیادآور باشد که امروزه نیاز به چنین وسیلهای شدیدا احساس میشود.
این وسیله که زیستسازگار و قابلحل در آب است به آرامی دور تا دورِ اعصاب را فرا میگیرد و آن منطقه را خنک میکند و اعصاب را بیحس میکند و مانع انتقال سیگنالهای درد به مغز میشود. کاربر با استفاده از یک پمپ خارجی میتواند این وسیله را فعال کند و همچنین شدت اثر آن را کم و زیاد کند. زمانی که دیگر نیازی به این وسیله نباشد، به طور طبیعی جذب بدن میشود و برای خارج کردن آن نیازی به جراحی نیست.
طبق گفتهی محققان، برای بیمارانی که تحت جراحیهای عادی و جراحیهای قطع عضو قرار میگیرند و به داروهای بعد از عمل نیاز دارند، این وسیله میتواند بسیار ارزشمند باشد. جراحان میتوانند طی عمل این وسیله را کار بگذارند تا به کنترل درد بیمار بعد از عمل جراحی کمک کند.
این مقاله که در مجلهی ساینس، اول ژوئیه منتشر شده است، اثربخشی و طراحی این وسیله را در یک مدل حیوانی نشان میدهد.
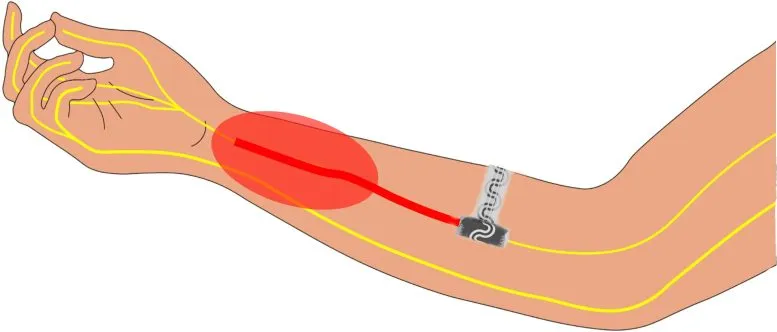
اثربخشی این دستگاه قابل کاشت و مسکن درد
تشریح این دستگاه قابل کاشت داخل بازو. این دستگاه به آرامی دور تا دورِ اعصاب محیطی را فرا میگیرد و مانع انتقال سیگنالهای درد به مغز میشود.
جان اِی راجرز از دانشگاه نورث وسترن که طراحی و توسعهی این دستگاه را رهبری کرده است میگوید: «اگرچه مسکنهای مخدر اثربخشی زیادی دارند اما بسیار اعتیادآور نیز هستند. به عنوان مهندسین این طرح، تسکین درد بیمار بدون دارو و به طریقی که دستگاه تحت کنترل کاربر باشد و فورا فعال و غیرفعال شود، به ما انگیزه میدهد. این تکنولوژی از ساز وکاری استفاده میکند که بسیار شبیه به زمانی است که انگشتان در اثر سرما بیحس میشوند. این دستگاه قابل ایمپلت، همان تاثیر را به طور مستقیم و موضعی بر روی اعصاب موردنظر ما ــ حتی اعصابی که درون بافتهای نرم قرار دارند ــ خواهد داشت.»
جان اِی راجرز از محققان بیوالکترونیک در مرکز تحققیقاتی لوئیس سیمپسون و کیمبرلی کوئِری، استاد علوم مواد و مهندسی زیست پزشکی و جراح عصبشناس در دانشکدهی مک کورمیک و دانشکدهی پزشکی نورث وسترن است او همچنین مدیر سرمایهگذاری در مرکز سیمپسون کوئری است. جاناتان ریدر مولف اصلی این مقاله از اعضای قبلی این مرکز تحقیقاتی است.
نحوهی عملکرد دستگاه
شاید این دستگاه خیالی به نظر برسد اما از یک مفهوم ساده یعنی تبخیر برای عملکرد خود استفاده میکند، همانطور که تبخیر عرق، بدن را خنک میکند این دستگاه حاوی مایع خنککننده است که در منطقهی خاصی از عصب حسی تبخیر میشود.
دکتر متیو مک ایوان از دانشگاه واشنگتن، دانشکده پزشکی سینت لوئیس میگوید: «وقتی عصبی را خنک میکنید سرعت سیگنالهای آن آهستهتر شده و نهایتا متوقف میشود. ما به طور خاص اعصاب محیطی ــ که سایر قسمتهای بدن را با مغز و عصب نخاعی مرتبط میکند ــ را مورد هدف قرار میدهیم. اعصاب محیطی، عصبهایی هستند که محرکهای عصبی از جمله درد را منتقل میکنند. با خنک کردن یک یا دو عصب موردنظر میتوانیم سیگنالهای درد را در یک منطقهی خاص از بدن تغییر دهیم.»
این دستگاه طی دورهای ۵۰ روزه به موادی زیستسازگار تجزیه و سپس در بدن جذب میشود. برای خنک کردن عصب، این دستگاه حاوی کانالهای ریزسیال است. یک کانال، حاوی مایع خنککننده پرفلوروپنتین است که قبلا به عنوان ماده حاجب فرا صوتی و برای استفاده در افشانههای فشاری کاربرد داشته است. کانال دیگر حاوی نیتروژن خشک (گاز بیاثر) است. وقتی این مایع و گاز وارد یک محفظهی مشترک میشوند واکنش صورت میگیرد که این مایع سریعا تبخیر میشود و به طور همزمان یک حسگر کوچک دمای عصب را کنترل می کند تا عصب خیلی سرد نشود زیرا باعث آسیب بافتی خواهد شد.
راجرز میگوید: «بیش از اندازه خنک کردن، باعث آسیب به عصب و بافتهای اطراف آن میشود. دما و مدت زمان خنک کردن باید دقیقا کنترل شود. با کنترل کردن دمای عصب، میزان جریان مواد به طور خودکار تنظیم میشود تا اینکه درد را متوقف کند و عصب هم به حالت اول خود قابل بازگشت باشد. تحقیقات ادامه دارد تا زمان و دمایی که در آن درد متوقف میشود و عصب به طور سالم میتواند به حالت قبلی خود برگردد، به طور کامل مشخص شود.»
میزان دقت
درحالی که سایر درمانهای خنککننده مورد آزمایش قرار گرفتهاند، همهی آنها محدودیتهای قابل توجهی داشتند که این دستگاه جدید ندارد. دانشمندان قبلا سرما درمانی را مورد بررسی قرار دادهاند که به طور مثال با تزریقات انجام میشود. در این روش غیردقیق، به جای هدف قرار دادن عصبهای خاص، منطقهی وسیعی از بافت خنکسازی میشود که میتواند باعث عوارض جانبی ناخواسته مانند التهاب و آسیب بافتی بشود.
پهنترین قسمت این دستگاه جدید فقط ۵ میلی متر است. یک سمت این دستگاه، دور عصب را احاطه میکند و نیازی به بخیه نیست؛ بنابراین عصب را به طور دقیق هدف قرار میدهد و منطقهی اطراف عصب خنک نمیشود و عوارض جانبی ایجاد نمیکند.
مک ایوان میگوید: «ما نمیخواهیم عصبها و بافتهای دیگر که در انتقال محرکهای درد نقش ندارند را خنک کنیم. میخواهیم سیگنالهای درد را متوقف کنیم، قصد نداریم اعصابی را متوقف کنیم که حرکات بدن ما را کنترل میکنند.
محققان قبلی روشهایی را بررسی کردهاند که با استفاده از تحریک الکتریکی، محرکهای درد را متوقف میکنند این روشها نیز محدودیتهایی دارند. در این روشها بدون تحریک اولیه ، نمیتوان سیگنالهای عصب را متوقف کرد که این تحریک اولیه، خودش باعث درد بیشتر برای بیمار میشود که اصلا مطلوب نیست.
جذبشدن دستگاه
این دستگاه جدید سومین دستگاه الکترونیکی زیستجذبپذیر از مرکز تحقیقاتی راجرز است که در سال ۲۰۱۲ مفهوم دستگاههای الکترونیکی موقتی را معرفی کرد. در سال ۲۰۱۸ اولین دستگاه زیستجذبپذیر را معرفی کردند که ترمیم اعصاب را تسریع میکرد که در مجلهی نیچر مدیسین منتشر شد. در سال ۲۰۲۱ یک دستگاه تنظیم ضربان قلب معرفی کردند که در نیچر بیوتکنولوژی منتشر شد.
تمام این دستگاهها زیستسازگار هستند و طی یک دورهی زمانی جذب بدن میشوند. این دستگاه ها مانند بخیههای قابلجذب، بیخطر هستند.
این دستگاه نرم، نازک و انعطافپذیر برای درمان عصبهای بسیار حساس، ایدهآل است. راجرز میگوید: «در مورد بافتهای نرم بدن، عصبهای حساس و ظریف و بدنی که دائما در حال حرکت است، هر وسیلهی درمانی باید به آسانی و به طور طبیعی قابلیت انعطاف پذیری، خمشدن و کش آمدن را داشته باشد؛ علاوه براین بیمار هم مایل است بعد از دوره درمان که دیگر احتیاجی به این دستگاه ندارد، دستگاه جذب بدن شود و برای خارج کردن آن از بدن نیازی به جراحی نباشد.
منبع: خنک کنندههای نرم و زیستسازگار برای متوقف کردن فعالیت اعصاب محیطی به طور موقت اثر جاناتان ریدر، کوانسان یانگ، مین هو سئو، ینگ یان، یوجون دنگ، کاترین آر جینکینز، سدهارث آر کریشنان، شنون مک کِی، امیلی پتنود، الکساندرا جانسون، مون جو کیم، آیوی هوانگ، رادل آویلا، کریستوفر فلیسلی، امیلی رِی، ژو جیو، ویلسون رِی، یونجانگ هوانگ، متیو آر مکایوان و جان اِی راجرز، سیام ژوئن ۲۰۲۲، مجلهی ساینس.
این مطاله با حمایتهای مرکز تحقیقاتی the Phil and Penny Knight Campus for Accelerating Scientific Impact و همچنین مرکز تحقیقاتی بیوالکترونیک کوئری و سیمپسون و موسسه ملی علوم (National Science Foundation) انجام شده است.